Des liquides poreux !
Les matériaux solides poreux comme le carbone divisé (le charbon actif), les zéolithes et des complexes organométalliques particuliers sont caractérisés par une énorme surface de contact due à leurs innombrables pores. Ils sont utilisés dans de nombreux processus de séparation de molécules ou de catalyse. Mais l’utilisation de solides n’est pas idéale dans nombre d’applications. Par exemple, pour capturer le CO2 produit par les centrales thermiques et d’autres usines, il serait avantageux d’utiliser des solvants liquides qu’on pourrait faire circuler dans des canalisations existantes facilement modifiables. Une équipe internationale de chercheurs de Grande Bretagne, d’Argentine, d’Allemagne et de France ont mis au point dans ce but des fluides qui possèdent une porosité permanente.
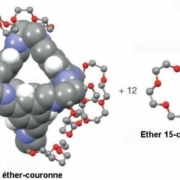
Pour cela, ils ont synthétisé des cages rigides de molécules organiques, formant chacune une pore, et les ont dissoutes dans un solvant dont les molécules sont trop grandes pour pénétrer dans les pores. Les pores restent ainsi vides dans le solvant et prêtes à capter des molécules de taille suffisamment faible. Le premier solvant utilisé a été l’éther couronne 15-couronne-5.
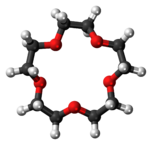 les atomes d’oxygène sont rouges, ceux de carbone bleus et ceux d’hydrogène gris clair. Crédit Wikimedia CC.
les atomes d’oxygène sont rouges, ceux de carbone bleus et ceux d’hydrogène gris clair. Crédit Wikimedia CC.La préparation de cages moléculaires dissoutes dans le solvant
N. Giri et al. ont préparé des cages rigides de molécules organiques. La figure 1 schématise la synthèse de la cage à partir d’un composé d’éther-couronne et sa dissolution dans l’éther couronne15-couronne-5. Pour qu’elles soient fortement solubles dans le solvant 15-couronne-5, chaque cage a été munie à sa surface de six groupes éther-couronne. Chaque cage (appelée cage éther couronne) a en son centre une cavité d’environ 5 Å de diamètre qui s’ouvre sur l’extérieur de la cage par 4 fenêtres d’un diamètre d’environ 4 Å.
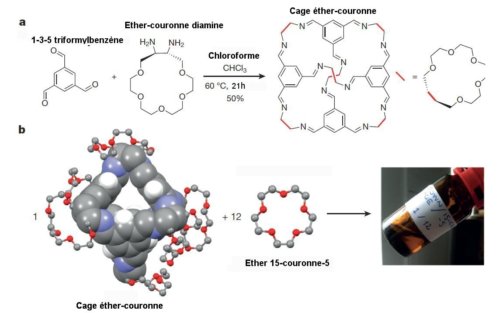
Fig.1.
a) Synthèse de la cage éther couronne. Du 1-3-5 triformylbenzène est ajouté à de l’éther couronne diamine (éther couronne muni de deux radicaux amine). L’ensemble est mis dans du chloroforme maintenu à 60°C pendant 21 H.
b) La molécule cage a une cavité dont la taille définit celle des pores. Ses atomes sont fortement agrandis par rapport à ceux qui l’entourent Elle est dissoute dans le solvant éther 15-couronne-5. Celui-ci est très fluide mais ses molécules ne peuvent pénétrer dans les cavités des cages.
On a représenté les atomes de carbone C en gris, ceux d’oxygène O en rouge, ceux d’azote N en bleu et ceux d’hydrogène H en blanc. Ces derniers ont été omis par souci de clarté à l’exception de ceux attachés aux structures aromatiques de la cage.
Adapté de Nicola Giri, Mario G. Del Pópolo, Gavin Melaugh, Rebecca L. Greenaway, Klaus Rätzke, Tönjes Koschine,
Laure Pison, Margarida F. Costa Gomes, Andrew I. Cooper & Stuart L. James
Nature,vol 527, 12 november 2015, avec autorisation.
Comme le montre la figure suivante, le méthane se dissout environ 5 fois plus dans le « liquide poreux » que dans le solvant 15-couronne-5.
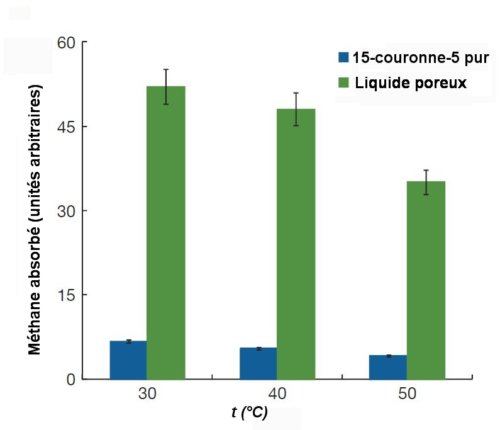
Fig.2. Diagramme montrant l’absorption de méthane par le solvant 15-couronne-5 pur et le liquide poreux 15-couronne-5 contenant les cages. Adapté de Nicola Giri, Mario G. Del Pópolo, Gavin Melaugh, Rebecca L. Greenaway, Klaus Rätzke, Tönjes Koschine, Laure Pison, Margarida F. Costa Gomes, Andrew I. Cooper & Stuart L. James. Nature,vol 527, 12 november 2015, avec autorisation.
Le liquide poreux à cages moléculaires mélangées
Bien que les performances des liquides poreux de ce type soient un peu inférieures aux solides poreux pour le stockage des gaz, ils sont bien adaptés à certaines configurations industrielles et à d’autres applications comme la séparation des gaz qui utiliseraient la forte concentration des cavités des cages dans le liquide. La synthèse du liquide poreux du type à cages éther-couronne nécessite de nombreuses étapes. L’équipe de chercheurs a mis au point une méthode alternative où un mélange de diamines est utilisé pour obtenir un mélange de différentes cages qui ont toutes des dimensions du cœur identiques à celle du cœur des cages du liquide poreux précédent. On prépare facilement ces « cages mélangées » à partir de produits chimiques courants par une synthèse à une seule étape. Les » cages mélangées » ont une plus grande solubilité dans les solvants organiques ordinaires que les cages précédentes. On les dissout donc facilement dans un solvant organique comme l’hexachloropropène. Le liquide poreux ainsi obtenu présente une bien meilleure solubilité des gaz que le liquide poreux à cages éther couronne dans 15-couronne-5 et une aussi bonne porosité. Mais surtout, dans ce liquide poreux facilement saturé de xénon, l’addition d’un peu de chloroforme, CHCl3, qui peut pénétrer les cages, libère rapidement le xénon alors que l’addition de liquides organiques de taille moléculaire plus grande n’a aucun effet. On a donc là une possibilité de contrôle de la solubilité d’un gaz dans le liquide poreux par l’addition d’une très faible quantité d’un second solvant. On peut observer cet effet sur la vidéo suivante :
[jwplayer mediaid= »20911″]
Des échantillons de liquide poreux (cages mélangées dans hexachloropropène) de 1 mL chacun sont introduits dans deux fioles. Ils sont tous deux saturés de xénon (par injection durant 5 minutes d’un débit de gaz xénon de 50mL/min).
On place dans chacune des fioles un agitateur magnétique (objet blanc sur la vidéo). Dans la fiole de gauche on ajoute du chloroforme CHCl3 (16 µL, soit 1 Mole) et dans celle de droite du 1-t-butyl-3,5-diléthylbenzène (36µL, soit 1Mole). Dans les deux fioles on a pris soin de ne pas mélanger les solvants. On déclenche l’agitation dans les deux fioles. On observe bien, à gauche que le chloroforme déplace le gaz xénon, tandis qu’à droite le solvant de taille moléculaire plus élevée ne le déplace pas.
Crédit Nicola Giri, Mario G. Del Pópolo, Gavin Melaugh, Rebecca L. Greenaway, Klaus Rätzke, Tönjes Koschine, Laure Pison, Margarida F. Costa Gomes, Andrew I. Cooper & Stuart L. James. Nature,vol 527, 12 november 2015, avec autorisation.
Ces liquides poreux ne rivalisent pas avec les solides poreux pour ce qui est de la surface par unité de volume ni de l’absorption de gaz par unité de masse, du moins dans l’immédiat. Mais ils sont adaptés à certaines applications industrielles de captation de gaz et ils constituent une nouvelle génération de matériaux poreux. Enfin la possibilité de contrôler la solubilité d’un gaz dans les liquides poreux à cages mélangées ouvre la voie à d’intéressantes applications.
Pour en savoir plus :
Liquids with permanent porosity
Nicola Giri, Mario G. Del Pópolo, Gavin Melaugh, Rebecca L. Greenaway, Klaus Rätzke, Tönjes Koschine,
Laure Pison, Margarida F. Costa Gomes, Andrew I. Cooper & Stuart L. James
N AT U R E | VO L 5 2 7 | 1 2 nove m b er 2 0 1 5
Liquefied molecular holes
Michael Mastalerz
N AT U R E | VO L 5 2 7 | 1 2 N O V E M B E R 2 0 1 5