Du carburant hydrocarbure obtenu à partir du CO2 contenu dans l’eau de mer
En mars de cette année, des chercheurs de l’U.S. Naval Research Laboratory à Washington, USA, ont fait voler un petit avion modèle réduit propulsé par un moteur à explosions alimenté par un hydrocarbure liquide obtenu à partie du C02 et de l’hydrogène contenus dans l’eau de mer.
Ce vol de démonstration, pour lequel le moteur deux temps de la maquette n’a pas été modifié, est un symbole de l’aboutissement des travaux des chercheurs du NRL. Les techniques qu’ils ont mis au point leur ont permis d’extraire le dioxyde de carbone (CO2 ) et l’hydrogène contenus dans l’eau de mer avec un rendement de 92% et de les convertir en carburant hydrocarbure liquide.
Un hydrocarbure est un composé organique constitué d’atomes de carbones (C) et d’hydrogène (H). Sa formule chimique est de la forme : CnHm, où n et m sont entiers. Le pétrole est principalement composé d’hydrocarbures.
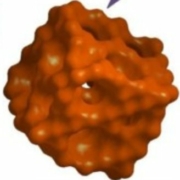
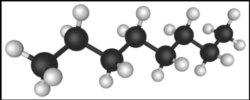 Représentation en 3 dimensions de la molécule de l’octane, C8H18, les atomes de carbone sont les sphères noires, ceux d’hydrogène sont les sphères blanches. Crédit Wikipedia.
Représentation en 3 dimensions de la molécule de l’octane, C8H18, les atomes de carbone sont les sphères noires, ceux d’hydrogène sont les sphères blanches. Crédit Wikipedia.
Le CO2 est une source de carbone présente dans l’air et l’eau de mer mais la concentration dans les mers (100 milligrammes/L ) est environ 140 fois plus élevée que dans l’air.
Deux à trois pour cent du CO2 dissous dans l’eau de mer l’est sous la forme d’acide carbonique (H2CO3), un pour cent sous la forme de carbonate (CO3–) et les 96 à 97 pour cent restants sous la forme de bicarbonate ( HCO3–).
1-L’extraction du gaz carbonique de l’eau de mer
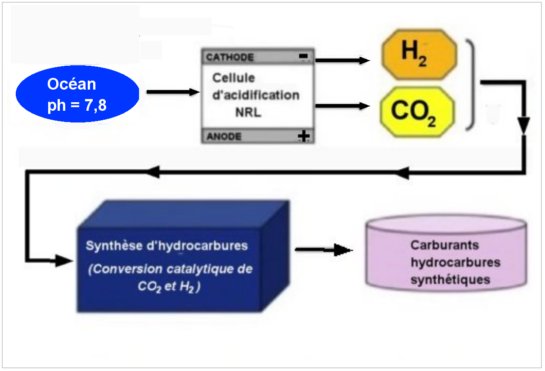
La première étape du procédé consiste à extraire CO2 et H2 de l’eau de mer avec une consommation d’énergie minimum. Les ions dissous, bicarbonate et carbonate sont les principaux responsables de la stabilité du pH de l’océan qui est de l’ordre de 7,8 (basique) .
Or, si on abaisse le pH de l’eau de mer à une valeur inférieure à 6 (acidification), le CO2 est dissocié et facilement pompé. Pour faire cela et obtenir en plus de l’hydrogène, H. Willauer et son équipe ont imaginé une cellule électrochimique d’acidification capable de décomposer l’eau en H+, OH–, hydrogène gazeux (H2) et oxygène gazeux (O2). Elle se compose (figure 2 ci-dessous) d’un compartiment central d’échange d’ions, de deux compartiments d’électrodes (anode et cathode) et, séparant les trois compartiments, de membranes perméables aux cations (ions chargés positivement) et non aux anions (ions négatifs).
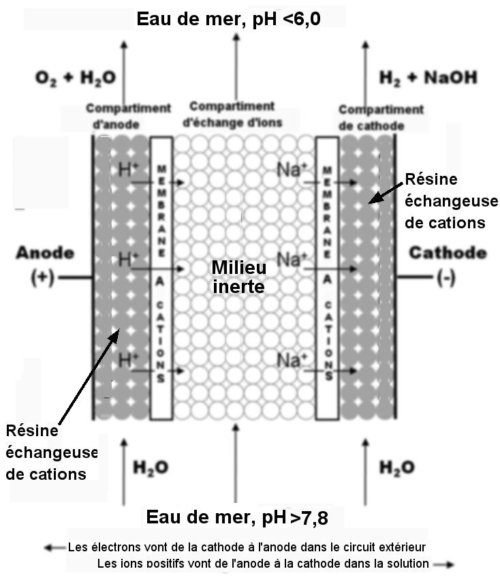
Fig.2. Schéma de la cellule d’acidification. L’eau de mer traverse le compartiment central et en ressort avec un pH diminué (acidification par les ions H+). De l’eau douce est injectée dans les compartiments d’anode et de cathode.
Crédit Heather D. Willauer, Naval Research Laboratory.
L’extraction d’hydrogène de l’eau consomme de l’énergie électrique, mais celle-ci est se retrouvera dans le carburant que l’on va ensuite synthétiser.
La photographie ci-dessous (Fig. 3) montre une telle cellule montée avec sur un châssis à palette avec son alimentation, sa pompe et un système d’osmose inverse pour obtenir l’eau douce nécessaire.

Fig.3. Module de laboratoire d’extraction du CO2 et de H2 de l’eau de mer sous forme compacte (1,5m x 0,9m x 1,5m). Il tient sur une palette.
Crédit Heather D. Willauer, U.S.Naval Research Laboratory.
Un tel système ne nécessite pas d’addition de produits chimiques. L’eau de mer traitée peut être rejetée sans contamination. Aucun équipement supplémentaire pour la production d’hydrogène n’est nécessaire. En revanche un volume relativement grand d’eau de mer doit être traité : 23 000 litres (contenus dans un réservoir de 4m x 3m x 2m) pour chaque litre de carburant obtenu. Il faut ensuite synthétiser des hydrocarbures liquides à partir du gaz carbonique et de l’hydrogène.
2- La synthèse d’hydrocarbures à partir de dioxyde de carbone et d’hydrogène
Cette deuxième étape se décompose en deux temps.
Dans le premier, un catalyseur à base de fer permet d’obtenir une conversion du CO2 et de H2 en hydrocarbures insaturés (les alcènes).
Dans le second, ces alcènes sont convertis à l’aide d’autres catalyseurs (des zéolithes, alumino-silicates purs ou chargés de nickel) en hydrocarbures de poids moléculaires plus élevés.
Les deux opérations se déroulent à la suite dans un même réacteur chimique de faible encombrement.
Le liquide obtenu contient des molécules d’hydrocarbures dont le nombre d’atomes de carbone va de 6 à 9 (C6 à C9 ) et il est utilisable comme carburant d’un turboréacteur d’avion.
3-Dispositif final
On a schématisé ci-dessous l’ensemble du dispositif (Fig. 4).
Le NRL envisage de fabriquer de tels systèmes embarqués sur un porte-avion. Cela assurerait le ravitaillement des avions du navire. Il est aussi prévu de réaliser des usines au sol pouvant fournir du carburant liquide si nécessaire pour les transports. On pense enfin à coupler de tels dispositifs avec des sources d’énergie électrique renouvelables, éoliennes, hydroliennes ou encore systèmes d’exploitation de l’énergie de la houle.
Voici un court film où l’on pourra voir quelques vues de l’appareillage de laboratoire et le vol historique de la maquette.
[jwplayer mediaid= »18190″]
Crédit Heather D. Willauer, Naval Research Laboratory.
Pour en savoir plus :
– Development of an Electrochemical Acidification Cell for the Recovery of CO2 and H2 from Seawater
Heather D. Willauer, Felice DiMascio, Dennis R. Hardy, M. Kathleen Lewis and Frederick W. WilliamsIndustry & Engineering Chem. Res. 2011, 50, 9876–9882
– Hydrocarbon Synthesis from Carbon Dioxide and Hydrogen: A Two-Step Process
David M. Drab, Heather D. Willauer, Matthew T. Olsen, Ramagopal Ananth, George W. Mushrush, Jeffrey W. Baldwin, Dennis R. Hardy and Frederick W. Williams
Energy Fuels 2013, 27, 6348−6354