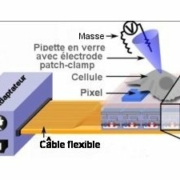
Le contrôle optogénétique de neurones par des matrices d’OLEDs
L’optogénétique est une nouvelle méthode pour contrôler par la lumière le comportement des cellules. Des scientifiques de l’Université de Saint Andrews en Angleterre ont utilisé des matrices de microscopiques OLEDs (6 µm x 9 µm) pour exciter avec de la lumière des cellules avec une résolution spatio-temporelle inégalée.
On appelle transgène un gène ou une séquence isolée d’un gène que l’on transfère d’un organisme à un autre.
Jusqu’ici, on a utilisé comme sources de lumière pour les expériences en optogénétique des lampes à arc, des lasers ou des LEDs. Pour des cellules maintenues vivantes en culture, la lumière est appliquée à travers l’objectif d’un microscope, tandis que, pour des expériences in vivo, elle l’est à travers des fibres optiques arrivant aux cellules cibles. Mais la résolution spatiale de ces sources de lumière reste limitée à des dimensions nettement plus grandes que celles de la taille d’une cellule et le nombre de points pouvant être indépendamment illuminés est faible.
Les scientifiques britanniques ont utilisé des LEDs organiques, les OLEDs, diodes émettrices de lumière constituées de matériaux issus de la chimie organique. Leurs caractéristiques sont prometteuses pour la biotechnologie et la biomédecine. En effet, leur spectre d’émission est facilement ajustable, elles sont légères et flexibles, elles sont de très faible toxicité biologique, elles chauffent peu, elles ont une forte intensité lumineuse et des temps de coupure et d’allumage inférieurs à la microseconde. Enfin elles permettent une forte résolution spatiale, ce qui les rend extrêmement intéressantes pour l’optogénétique. La taille des pixels réalisés par les chercheurs est de 6 µm x 9 µm.
Néanmoins, le contact des matériaux organiques avec un milieu biologique aqueux est à éviter. C’est pour cela que la matrice d’OLEDs réalisée (Fig.1.) est rendue étanche par dépôt de films minces.
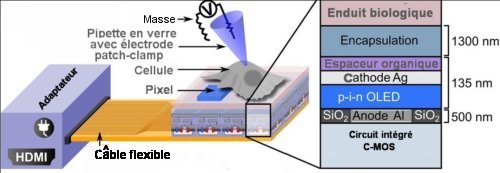
Fig.1. Schéma de l’excitation optogénétique d’une cellule par une
matrice d’OLEDs
Une cellule (dessinée sans tenir compte de l’échelle) est placée sur la micromatrice d’OLEDs. Celle-ci est connecté à un adaptateur HDMI. Ce dernier permet, en agissant sur le circuit intégré C-MOS d’allumer ou d’éteindre chaque pixel de la matrice, contrôlant ainsi l’exposition lumineuse de la cellule. Les variations dues à la lumière du courant dans la membrane cellulaire sont mesurées avec une électrode patch clamp fonctionnant dans le mode à potentiel constant.
L’insert élargi de droite détaille la structure de la matrice d’OLEDs. L’enduit biologique à la surface de la matrice permet aux cellules d’adhérer à cell-ci.
Adapté de Arrays of microscopic organic LEDs for high-resolution optogenetics
Anja Steude, Emily C. Witts, Gareth B. Miles, Malte C. Gather, Science Advances 2016; 2 : e1600061, 6 May 2016 CC BY-NC 4.0.
C’est sur des cellules embryonnaires de rein humain modifiées génétiquement (cellules HEK-23, pour human embryonic kidney) que les chercheurs ont démontré que des matrices d’OLED microscopiques activaient en temps réel spécifiquement les canaux ioniques des membranes de cellules individuelles. Ceci modifie alors le courant entre l’intérieur de la cellule et son environnement. Les variations de courant ainsi obtenues sont de l’ordre de celles nécessaires pour induire un signal d’influx nerveux dans les neurones.
La figure ci-dessous présente une photographie de l’appareillage correspondant au schéma de la Fig.1.
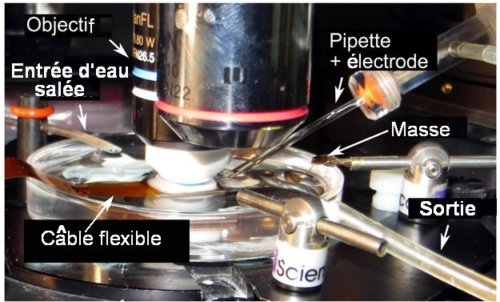
Fig.2. Photographie du dispositif expérimental
Le microscope équipé d’un objectif à immersion à eau est utilisé pour positionner directement l’électrode. La micro-matrice et l’électrode de masse sont placées dans une boîte de Pétri remplie de solution d’eau salée (sérum physiologique). Le câble flexible rejoint l’adaptateur HDMI situé hors du champ. Une circulation de fluide renouvelle constamment la solution salée.
Adapté de Arrays of microscopic organic LEDs for high-resolution optogenetics
Anja Steude, Emily C. Witts, Gareth B. Miles, Malte C. Gather, Science Advances 2016; 2 : e1600061, 6 May 2016 CC BY-NC 4.0.
Les cellules HEK-23 ont été génétiquement modifiées pour les munir d’un canal ionique dit channelrhodorpsin-2, abrégé en ChR2 qui est contrôlable par la lumière. Par exposition à une lumière bleue, le canal s’ouvre, il reste ouvert dans le noir et il peut se refermer par exposition à une lumière verte ou rouge. A l’ouverture du canal, des ions Ca2+, Na+, H+ pénètrent dans la cellule et modifient le potentiel de la membrane. c’est ainsi que fonctionne la transmission de signal dans les neurones.
La figure ci-dessous met bien en évidence, d’une part l’ouverture et la fermeture des canaux par activation optogénétique, d’autre part la résolution spatiale des micro-matrices d’OLEDs
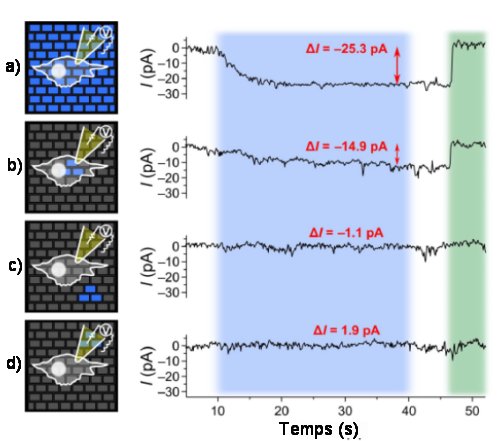
Fig.3. Résolution spatiale de l’activation optogénétique par
micro-matrice d’OLEDs.
Une cellule HEK-23 est excitée par différents motifs de pixels lumineux bleus pendant 30s, puis désactivée par de la lumière verte correspondante. On enregistre au cours du temps le courant entre intérieur de la cellule et son environnement.
a) tous les pixels sont allumés; activation du canal ionique.
b) trois pixels allumés sous la cellule : activation du canal ionique.
c) trois pixels allumés près mais en dehors de la cellule : pas d’activation.
d) trois pixels allumés près de la cellule et sous la pipette : pas d’activation.
On voit qu’il n’y a excitation du canal ionique que si la lumière est appliquée à la cellule.
Adapté de Arrays of microscopic organic LEDs for high-resolution optogenetics
Anja Steude, Emily C. Witts, Gareth B. Miles, Malte C. Gather, Science Advances 2016; 2 : e1600061, 6 May 2016 CC BY-NC 4.0
Le spectre d’émission des OLEDs peut être ajusté à la réponse spectrale de toute protéine du type des ChR. En utilisant la superposition de deux matrices indépendantes d’OLEDs de couleurs différentes, on pourrait même contrôler deux cibles voisines sensibles à la lumière.
En raison des avantages qu’elles procurent, les OLEDs vont permettre de développer une plateforme technologique pour étudier et contrôler des processus biologiques dans des cellules isolées ou dans des organismes complets.
Au lieu d’avoir une sonde sur un seul neurone, on peut même envisager d’implanter des matrices flexibles d’OLEDs à la surface du cerveau. Avec des algorithmes d’apprentissage automatique, on pourrait sonder des parties du cerveau et corréler les signaux des neurones. On obtiendrait ainsi des mesures plus fines que celles actuellement réalisées avec des micro-électrodes nettement plus grandes. Cela pourrait permettre d’étudier les dysfonctions neuronales qui semblent être à la base de maladies neuro-dégénératives parmi lesquelles on peut citer la maladie d’Alzheimer et la maladie de Parkinson.
Pour en savoir plus :
Arrays of microscopic organic LEDs for high-resolution optogenetics
Anja Steude, Emily C. Witts, Gareth B. Miles, Malte C. Gather, Science Advances 2016; 2 : e1600061, 6 May 2016