Un escargot qui fabrique de l’électricité !
On a suggéré récemment d’implanter des cellules à biocarburant dans des organismes vivants pour obtenir des micro-sources d’énergie. Des chercheurs de l’Université de Clarkson, Postdam, New York aux Etats-Unis ont réussi pour la première fois à implanter dans un escargot vivant une cellule à biocarburant à fonctionnement continu. Et celle-ci a produit de l’électricité durant une longue durée en consommant le glucose produit physiologiquement par l’escargot.

Fig1.Photographie d’un escargot avec deux électrodes biocatalytiques connectées par des pinces crocodiles au circuit extérieur. Crédit Jour. of Am. Ch.Soc. 1er mars 2012.
C’est par une approche tant chimique que biologique que les chercheurs dirigés par le Pr Evgeny Katz sont parvenus à ce résultat.
La réaction d’oxydoréduction en jeu dans la biocellule
Cette biocellule convertit directement en électricité l’énergie produite quand le glucose réagit avec l’oxygène durant le métabolisme normal. Pour ce faire, à une électrode, l’anode, du glucose est oxydé en acide gluconique avec production d’ électrons qui partent dans le circuit. A l’autre électrode, la cathode, de l’oxygène, O2, est réduite en eau.
On utilise deux électrodes dites biocatalytiques sur lesquelles sont fixées des enzymes particulières.
Ces électrodes conductrices sont constituées de « buckypaper », film de nanotubes de carbone compressés d’une épaisseur de quelques dixièmes de millimètre. Sur la cathode, l’enzyme laccase, oxydo-réductrice, assure la réduction de l’oxygène. A l’anode, pour l’oxydation du glucose, l’enzyme sélectionnée est la pyroloquinoléine quinone(PQQ) déshydrogénase glucose dépendante (PQQGDH) et sa fixation est beaucoup plus compliquée que pour l’enzyme de cathode.
Ces deux électrodes sont implantées dans un escargot (Neohelix albolabris) grâce à deux trous pratiqués dans la coquille.
Elles sont placées dans l’hémolymphe entre la paroi de la cavité et la masse des organes internes.
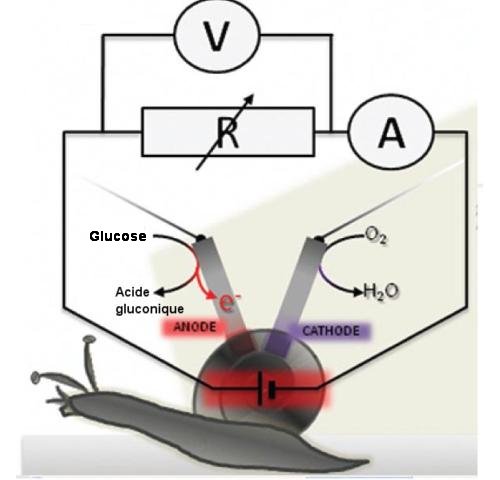
Fig.2. Circuit électrique des bioélectrodes implantées. A l’anode, oxydation du glucose en acide gluconique. A la cathode, réduction de l’oxygène. Crédit Jour. of Am. Ch.Soc. 1er mars 2012.
Ces animaux continuent à vivre, se nourrir et se déplacer. Ils ont pu vivre longtemps (plusieurs mois) avec les électrodes implantées.
La puissance que ces dispositifs peuvent fournir est limitée, elle est de 7,45 microwatts qui chutent à 1,5 microwatts après trois quarts d’heure de fonctionnement. Si on limite la puissance à 0.16 microwatts, on obtient un fonctionnement continu dans lequel la consommation de glucose à l’anode est compensée par la production métabolique de celui-ci.
A l’Université Joseph Fournier de Grenoble, une équipe dirigée par Philippe Cinquin a implanté des cellules à biocarburant dans des rats. Dans ce cas, une complication supplémentaire vient du fait qu’il faut munir les cellules à biocarburant de membranes compatibles avec l’organisme pour éviter tout phénomène de rejet.
Ces expériences rendent envisageable la réalisation de cellules implantées dans un corps humain et fournissant de l’énergie à des dispositifs comme un pacemaker, un sphincter urinaire artificiel ou des capteurs biologiques.
Pour en savoir plus: Lenka Halámková, Jan Halámek, Vera Bocharova, Alon Szczupak, Lital Alfonta, and Evgeny Katz. J. Am. Chem. Soc. 2012, 134, 5040−5043




