Une nouvelle batterie économique pour le stockage de grandes quantités d’électricité
Le caractère intermittent de l’électricité fournie par des panneaux solaires et des éoliennes impose de pouvoir stocker cette énergie durant les périodes de production. On peut alors l’injecter dans les réseaux de distribution quand il en est besoin. Mais le stockage de l’énergie électrique à cette échelle requiert des capacités de plusieurs centaines de gigawatt-heures et des systèmes qui soient économiques, sûrs et non polluants. Les batteries rechargeables actuelles, de la batterie classique au plomb des automobiles aux plus récentes batteries au lithium, sont loin de répondre à ces critères. Une équipe de chercheurs de l’University of Southern California, Los Angeles, aux Etats-Unis, dirigée par le professeur Narayanan a mis au point une batterie à flux (c’est-à-dire à circulation d’électrolytes) qui utilise comme électrolytes des composés organiques solubles dans l’eau et sans réaction métallique aux électrodes. Ils l’ont nommée ORBAT (acronyme de Organic Redox Flow Battery, en français Batterie à Flux Redox Organique).
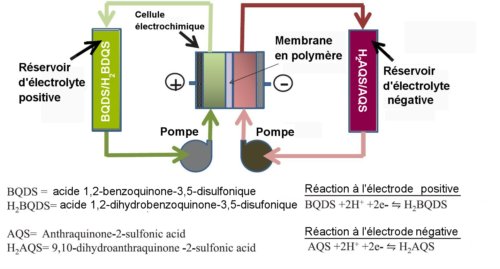
Fig.1. Schéma d’une batterie à flux Redox organique. Crédit S.R. Narayanan et al. Creative Commons Attribution.
Les progrès récents dans la technique des batteries ont principalement consisté à remplacer le plomb par le lithium, plus léger. Pour obtenir de plus grandes capacités de stockage, on a proposé des batteries à flux, c’est-à dire à circulation d’électrolytes qui pouvaient être stockés dans de grands réservoirs et utilisés à la demande. Les batteries à flux redox vanadium ont atteint un niveau de développement suffisant pour qu’on envisage de les utiliser pour le stockage à l’échelle d’un réseau de distribution d’électricité. Mais les ressources limitées en vanadium, son coût élevé et le danger de toxicité dû à la présence de grandes quantités de solutions de sels de vanadium ont empêché la diffusion de ce type de batteries. D’autres chercheurs ont proposé des batteries à flux à électrolytes organiques mais avec un couple redox à base de brome, liquide très réactif qui pose des problèmes de manipulation et de sécurité.
Les chercheurs de l’USC ont réalisé une batterie à flux utilisant des solutions aqueuses de produits organiques donnant lieu à des réactions d’oxydation-réduction (redox) avec des électrodes sans métal. Cet appareil utilise deux solutions aqueuses de substances organiques susceptibles d’oxydoréduction, des quinones, qui circulent en passant dans deux compartiments électrodes. L’électrode positive est séparée de l’électrode négative par une membrane en polymère laissant seulement passer les ions H+ c’est-à-dire des protons.
Comme cela est indiqué sur la figure 1, l’électrode positive utilise une solution d’acide 1,2- benzoquinone-3,5-disulfonique (BDQS) et l’électrode négative une solution d’acide anthraquinone-2-sulfonique (AQS). La sortie du courant est assurée dans les deux compartiments électrodes par des pièces en graphite. Il n’y a donc aucun métal lourd dans ce système électrochimique.
On reconnait l’hexagone du benzène, C6 H6 .On trouve des quinones dans les plantes, les champignons, les bactéries et quelques animaux. Les anthraquinones substituées, comme l’AQS, peuvent être synthétisées part des méthodes peu coûteuses. Mais ce sont aussi des produits naturels qu’on a extrait depuis longtemps de végétaux comme la rhubarbe et on peut penser que cela pourra fournir une source renouvelable de solutions d’électrolyte.
On a représenté ci-dessous les réactions de la figure 1 en formules développées :
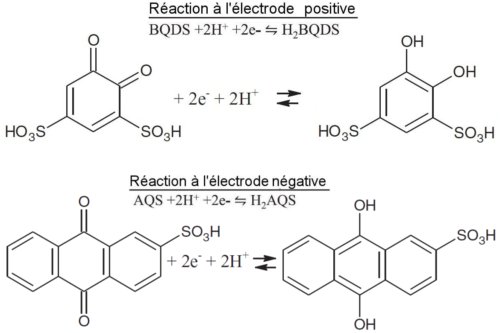
Fig.2. Réactions Redox de la batterie ORBAT sous la forme développée. Crédit S.R. Narayanan et al. Creative Commons Attribution.
Les expériences menées à l’U.S.C. ont montré qu’on pouvait charger et décharger à volonté les batteries à flux redox organique sans qu’elles se dégradent. Les solutions d’électrolytes à base de quinones sont très économiques. La configuration ORBAT offre donc, pour le stockage de l’électricité à l’échelle des grands réseaux de distribution, la possibilité de développer un système de batteries rechargeables sans métal qui soit de coût très raisonnable, qui utilise des matériaux renouvelables et qui ait un fort rendement . Cela pourrait constituer un formidable atout pour l’utilisation des énergies renouvelables.
Pour en savoir plus :
An Inexpensive Aqueous Flow Battery for Large-Scale Electrical
Energy Storage Based on Water-Soluble Organic Redox Couples
Bo Yang, Lena Hoober-Burkhardt, Fang Wang, G. K. Surya Prakash
and S. R. Narayanan
Journal of The Electrochemical Society, 161 (9) A1371-A1380 (2014)