Des venins plus puissants que la morphine pour calmer la douleur
La douleur, quand elle est supportable et temporaire, est un signal qui nous permet, par exemple, de nous écarter d’un danger. Au contraire, une douleur continue et chronique peut être extrêmement pénible et intolérable au point que seule la morphine puisse l’atténuer. Des chercheurs chinois et australiens ont étudié le venin du scolopendre de Chine à tête rouge (Scolopendra subspinipes mutilans) et ont découvert qu’une molécule peptide extraite de ce venin avait sur des rongeurs une puissance analgésique comparable à celle de la morphine et souvent plus élevée.
Crédit Wikipedia Commons
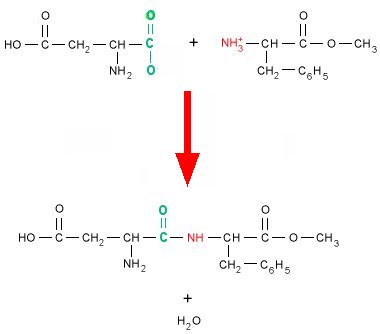
La molécule peptide Ssm6a isolée à partir du venin du scolopendre agit sur les canaux sodium Nav1.7 des membranes d’axones de neurone. Voyons ce que cela signifie.
La transmission nerveuse et les canaux sodium et potassium
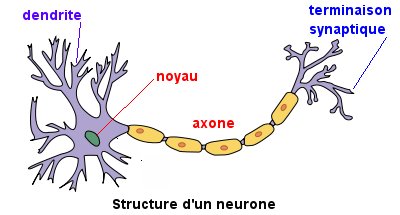
L’intérieur de l’axone contient des ions calcium. L’extérieur de la fibre est au contact d’ions sodium. Au repos, l’intérieur de la fibre est polarisé négativement par rapport à l’extérieur. Il existe tout le long de la fibre, dans sa membrane, des canaux dits sodium ou potassium qui peuvent laisser entrer ou sortir des ions sodium ou potassium. Ces canaux sont sensibles au potentiel électrique de l’influx nerveux (potentiel d’action). Lors d’un signal électrique, les canaux sodium à l’endroit de l’excitation laissent entrer des ions sodium modifiant ainsi le potentiel de repos de la fibre. De proche en proche, des canaux potassium laissent sortir des ions potassium pour rétablir le potentiel de repos et des canaux sodium laissent entrer de nouveau plus loin du sodium (voir la Fig .2).
Crédit Wikipedia Commons
L’animation suivante (Fig.2) schématise le mécanisme de transmission nerveuse.—
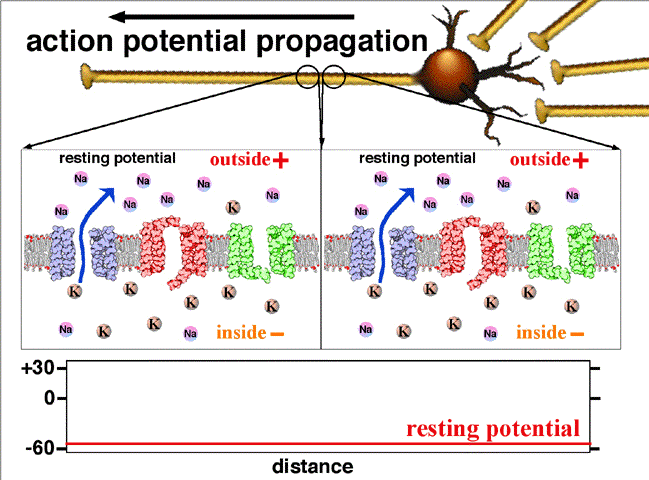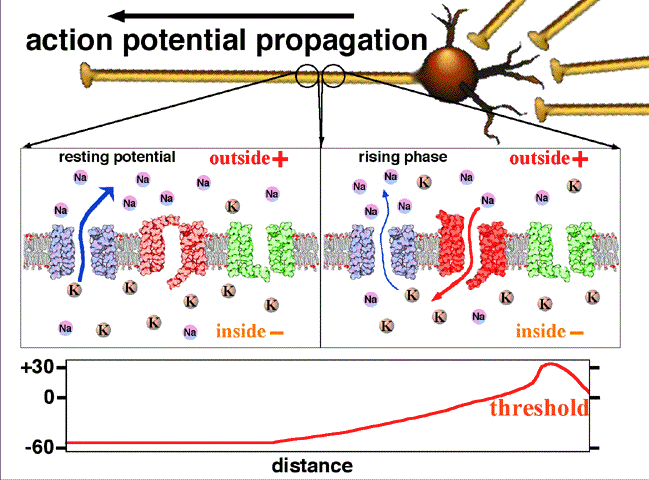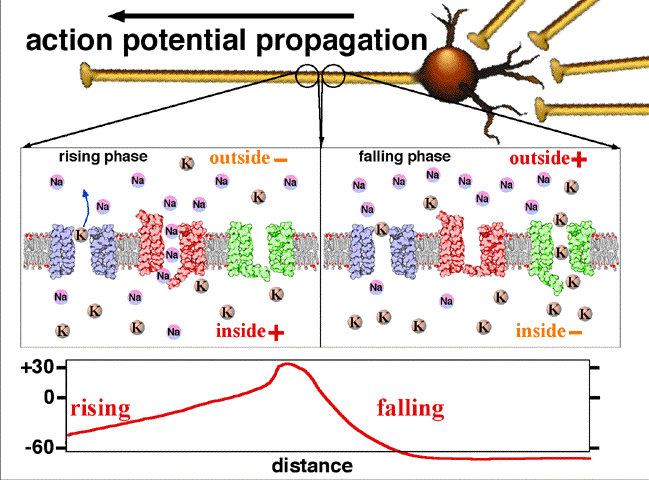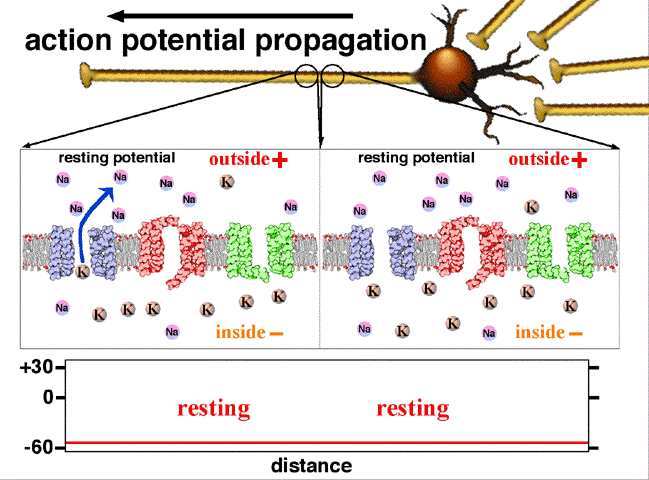
Fig.2. On y voit la propagation du potentiel d’action entre deux points d’un axone. Au repos le potentiel de l’intérieur de la fibre est négatif, -60 mV. L’entrée d’ions Na par un canal sodium en un point donné rend positif ce potentiel en cette région.
Traduction des indications : resting potential =potentiel de repos (en l’absence de signal nerveux); rising phase = phase d’augmentation (du potentiel); falling phase = phase de diminution; threshold = seuil( potentiel à partir duquel les ions sodium entrent dans le canal) ; peak = pic (de potentiel); falling = décroissant; depolarising = dépolarisant; inside = intérieur; outside = extérieur; resting = au repos. Crédit Wikipedia Commons.
L’action sélective du peptide Ssm6a sur les canaux sodium Nav1.7
La molécule qui agit sur la douleur a été extraite du venin de scolopendre (Scolopendra subspinipes mutilans) par chromatographie et purification chimique.
Sa capacité à bloquer les canauxNav1.7 a été testée in vitro sur des neurones provenant du ganglion de la racine dorsale la moelle épinière d’un rat adulte. Le blocage des canaux Nav1.7 est obtenu en quelques secondes. Et les autres types de canaux sodium ne sont pas bloqués.
L’effet analgésique de Ssm6a a été testé en l’injectant à des souris de laboratoire chez lesquelles on a induit de la douleur, soit par injection d’un produit irritant comme la formaline (solution aqueuse de formaldéhyde) ou l’acide acétique, soit par application de chaleur. Dans les deux premiers cas, on a observé une atténuation de la réaction à la douleur plusieurs fois plus efficace que celle obtenue avec de la morphine dans les mêmes conditions. Dans le cas de la douleur excitée par la chaleur, les efficacités de Ssm6a et de la morphine sont comparables.
Le peptide est stable dans le plasma humain et l’administration de 1 µmol/kg ne produit pas d’effets défavorables sue la tension artérielle, le rythme cardiaque ou les fonctions motrices. Il peut sembler paradoxal qu’un peptide de venin utilisé par un animal pour capturer des insectes puisse donner un produit thérapeutique. La réponse en est dans la grande différence entre la structure des canaux ioniques des insectes et des humains. En particulier, les insectes ont un seul type de canal Nav et son blocage par un peptide de venin induit une paralysie rapide suivie de mort.
Plusieurs médicaments dérivés de venins sont en expérimentation clinique ou pré-clinique, en particulier un dérivé d’un venin d’un gastéropode marin à coquille conique est déjà validé pour le traitement de douleurs sévères et inguérissables. Le venin de scolopendre qui, jusqu’ici, a été peu étudié, peut fournir une nouvelle source de molécule de départ pour le développement de médicaments anti-douleur bien tolérés.
Pour en savoir plus :
PNAS | October 22, 2013 | vol. 110 | no. 43 | 17539
Discovery of a selective NaV1.7 inhibitor from
centipede venom with analgesic efficacy exceeding
morphine in rodent pain models
Shilong Yanga,b Yao Xiaoa,b, Di Kanga,b, Jie Liuab, Yuan Lia,b, Eivind A. B. Undheimc, Julie K. Klintc,
Mingqiang Ronga, Ren Laia,, and Glenn F. Kingc
aKey Laboratory of Animal Models and Human Disease Mechanisms, Kunming Institute of Zoology, Chinese Academy of Sciences and Yunnan Province, China; bGraduate School of Chinese Academy of Sciences, Beijing, China; and cDivision of Chemistry and Structural Biology, Institute for Molecular Bioscience, The University of Queensland, St. Lucia, Australia