Un stockage réversible de l’hydrogène par capture électrochimique en milieu solide à température modérée
Un des grands problèmes rencontrés par des énergies renouvelables comme l’énergie solaire ou celle des éoliennes est la nécessité de les emmagasiner pour les utiliser lors des périodes de non-production.
Stocker l’hydrogène -combustible non polluant- dans des métaux a suscité de grands espoirs car les systèmes envisagés permettaient de s’affranchir des difficultés inhérentes au stockage à haute pression ou à l’état liquide à basse température. Celles-ci sont liées, par exemple, à la durabilité des matériaux, à la sécurité du réservoir, à son poids ou à la nécessité dans le second cas de maintenir la basse température.
Les hydrures métalliques sont des composés formés entre l’hydrogène et des métaux. Leur utilisation pour un stockage sûr de l’hydrogène dans un solide a été envisagée par des moyens thermodynamiques. Dans ce dernier cas, de faibles capacités de stockage étaient associées à des températures raisonnables tandis que de fortes capacités l’étaient à des températures supérieures à 300°C. Le stockage électrochimique de l’hydrogène dans des hydrures métalliques (avec une cathode métallique et un électrolyte liquide ou solide) avait été étudié mais s’était heurté, là encore, à des obstacles comme la haute température nécessaire et une mauvaise réversibilité.
Une équipe de chercheurs japonais (Takashi Hirose et al. ) ont mis au point un nouveau système d’ hydrure conducteur d’ions avec un électrolyte solide ayant une haute stabilité électrochimique. Ce procédé peut stocker réversiblement de l’hydrogène dans l’hydrure métallique à des températures modérées (60 à 100°C ) en utilisant une faible différence de potentiel (de l’ordre de 0,3 Volt). Cette dernière entraîne néanmoins une force de déplacement de l’hydrogène qui équivaut à celle engendrée par une pression de 1,4x 104 atm.
L’électrolyte solide utilisé est le composé : Ba0.5Ca0.35Na0.15D1.85 .
La Fig 1 ci-dessous représente en éclaté la structure du système de stockage de H2 et ses deux modes de fonctionnement : charge et décharge.
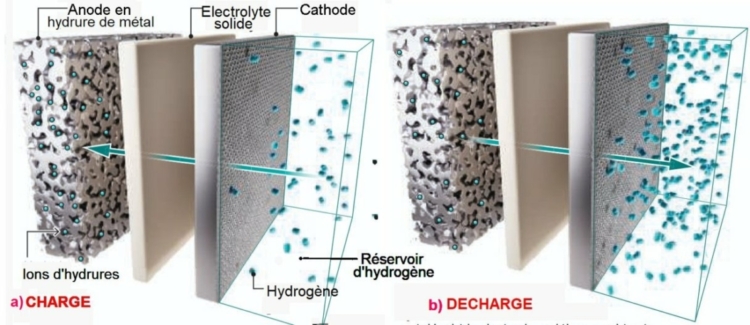
Fig.1. Mécanismes d’échange d’hydrogène dans la charge et la décharge.
a) Le gaz hydrogène passe à travers l’électrolyte solide sous la forme d’ions H– qui s’insèrent dans l’électrode sous la forme d’hydrures métalliques.
b) Les ions H– extraits de l’électrode en hydrure de métal vont se recombiner en H2 à la cathode.
Tiré de Solid-state hydrogen storage goes electric,
Ryan O’Hayre1 and Sossina M. Haile.
Science 18 septembre 2025 avec autorisation.
Utiliser un champ électrique plutôt que la température ou la pression est un gage de simplicité qui évite à la fois hautes températures et hautes pressions qui peuvent engendrer des problèmes difficiles à surmonter.
Les chercheurs ont essayé divers métaux et composés métalliques ainsi que divers électrolytes solides avant de concentrer leurs efforts sur le composé hydrure de magnésium MgH2 et de choisir comme électrolyte solide le composé Ba0.5Ca0.35Na0.15D1.85
Ce dernier présente une bonne conductivité des ions H (~2 x 10-5 siemens/cm) à température ambiante, une faible conductivité électronique (1,3 x 10–9 siemens/cm) et une stabilité sur un large domaine de tension. Il permet d’insérer et d’extraire des ions hydrogène d’une anode en hydrure de magnésium avec un rendement très élevé. On obtient ainsi dans des cellules Mg–H2 une capacité de stockage équivalente à une charge électrique par unité de masse de 2,03 Ah/g à la température modérée de 90°c.
L’électrolyte solide est placé entre une anode de stockage en hydrure de magnésium MgH2 et une cathode en LaHx qui a une bonne capacité d’échange d’hydrogène et d’excellentes conductivités d’ions H– et d’électrons. La figure 2 ci-dessous schématise la cellule et compare ses propriétés de stockage avec celles de deux autres types de système moins performants.
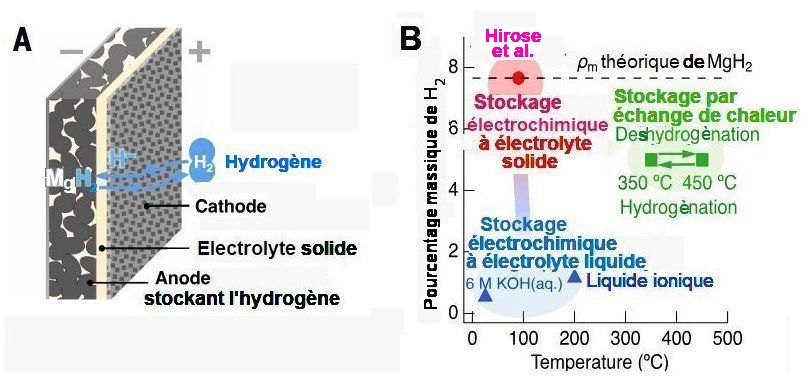
Fig.2. Cellule d’absorption- désorption de l’hydrogène A) Schéma d’une cellule métal-H2 B) Pourcentage (ρm) en poids de H2 dans l’anode de stockage en fonction de la température et comparaison avec le stockage par échange de chaleur (en vert). La ligne en pointillés indique le pourcentage théorique obtenable. Les données correspondant à un stockage électrochimique utilisant un électrolyte soit liquide, soit liquide ionique sont indiquées par les triangles bleus. Le cercle rouge correspond à la capacité de stockage obtenue à 90°C par la cellule Mg-H2. Tiré de High-capacity, reversible hydrogen storage using H–conducting solid electrolytes Takashi Hirose, Naoki Matsui, Takashi Itoh , Yoyo Hinuma, Kazutaka Ikeda, Kazuma Gotoh, Guangzhong Jiang, Kota Suzuki, Masaaki Hirayama, Ryoji Kanno Science 18 September 2025, avec autorisation.
Les chercheurs ont ainsi démontré que l’on pouvait extraire électro-chimiquement de l’électrode MgH2 le gaz hydrogène qu’on y avait stocké par ce moyen. Le système de stockage à électrode MgH2 dans des cellules échangeant des ions H– a des performances exceptionnelles incluant un bas coût, une bonne réversibilité et une grande capacité de stockage, cette dernière atteignable à des températures modérées (90°C). Une analyse simple indique que le stockage électrochimique pourrait surpasser encore plus les systèmes thermiques grâce à des améliorations telles que la réduction du potentiel nécessaire, la diminution de l’épaisseur de l’électrolyte solide et aussi l’augmentation de la masse du matériau actif dans l’anode composite.
Ces propriétés inatteignables par les anciennes méthodes, thermiques ou électro-chimiques ouvrent la voie à un système de stockage d’hydrogène efficace utilisable, par exemple, pour les énergies renouvelables et les véhicules non polluants.
Pour en savoir plus :
1) Takashi Hirose, Naoki Matsui, Takashi Itoh , Yoyo Hinuma, Kazutaka Ikeda, Kazuma Gotoh, Guangzhong Jiang, Kota Suzuki, Masaaki Hirayama,
Ryoji Kanno Science 18 September 2025.
2) Solid-state hydrogen storage goes electric,
Ryan O’Hayre and Sossina M. Haile Science 18 septembre 2025.