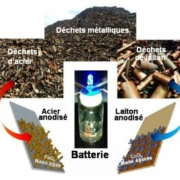
Des batteries ultra-rapides à partir de métaux de récupération
Une équipe de scientifiques de l’Université Vanderbilt à Nashville, Tenessee, USA, vient de démontrer la possibilité d’obtenir à bas coût, à partir d’acier et de laiton de récupération, des accumulateurs à cycle de charge-décharge ultra-court.
Les batteries modernes sont constituées de métaux purifiés, de matériaux dégradables par l’air et souvent d’électrolytes inflammables (batteries au lithium). Tout ceci conduit à des coûts élevés pour obtenir des accumulateurs sûrs et de forte densité d’énergie.
Au contraire, les premiers systèmes de batteries se résumaient à des métaux communs plongés dans un électrolyte. C’est le cas de l’accumulateur nickel –fer dû à Edison ou des classiques batteries plomb-acide des automobiles.
En s’inspirant de cela, les chercheurs de Vanderbilt University ont construit des batteries à recharge rapide très simples qui utilisent des déchets d’acier et de laiton inutilisés. Ceux-ci sont traités par un très élémentaire procédé électrolytique d’anodisation.
On obtient ainsi des électrodes nanostructurées à partir de laiton et d’acier ordinaire à bas taux de carbone. Ces électrodes plongées par paires dans des électrolytes aqueux fournissent une tension nominale allant de 1 à 1,8 V, avec des densités massiques d’énergies atteignant 20 Wh/kg et des densités massiques de puissance atteignant 20 kW/kg. Cette dernière valeur est d’un ordre de grandeur supérieur à celle des batteries au plomb.
La réalisation d’une batterie à base de déchets d’acier et de laiton
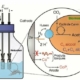
Deux électrodes anodisées, l’une en acier, l’autre en laiton, tous deux de récupération, sont plongées dans un électrolyte, solution aqueuse d’hydroxyde de potassium (KOH).

Fig.1. Schéma de la fabrication d’une batterie à partir de métaux de récupération
La photographie centrale représente l’une de deux telles batteries qui alimentent en série la DEL bleue que l’on y voit. L’électrolyte contenu dans la cuve est une solution aqueuse d’hydroxyde de potassium..
Reproduit de “From the Junkyard to the Power Grid: Ambient Processing of Scrap Metals into Nanostructured Electrodes for Ultrafast Rechargeable Batteries”.
Nitin Muralidharan, Andrew S. Westover, Haotian Sun, Nicholas Galioto, Rachel E. Carter, Adam P. Cohn, Landon Oakes, and Cary L. Pint. ACS Energy Lett. 2016, 1, 1034−1041 ©(2016) American Chemical Society
Alors que le laiton n’avait jamais été envisagé comme électrode de batterie, les chercheurs remarquèrent que les oxydes de cuivre CuOx fournissaient des couples redox de l’ordre de celui du nickel de la batterie Ni-Fe d’Edison.
On appelle » oxydant » une espèce chimique capable de capter un ou plusieurs électrons. Par exemple, l’ion Cu2+ est un oxydant car, en captant 2 électrons, il donne du cuivre : Cu2+ + 2e- = Cu ; On dit qu’on a un couple redox Cu2+/Cu.
On appelle » réducteur » une espèce chimique capable de céder un ou plusieurs électrons. Le zinc est un réducteur car il est capable de céder 2 électrons :
Zn = Zn2+ 2 e- . Le cuivre l’est aussi dans la réaction inverse de la première : Cu= Cu2+ + 2e- .
Toute batterie ou pile est le siège d’une ou plusieurs réactions redox où le transfert d’électrons se fait par le circuit extérieur à la batterie, circuit qu’il s’agit d’alimenter en courant.
Le cuivre est le composant principal du laiton (70% de Cu, 30% de Zn pour celui le plus répandu), il est nettement moins toxique que le nickel et trois fois moins cher que celui-ci, même de récupération. D’où l’idée d’utiliser l’acier ordinaire, le moins cher et le plus abondant métal de récupération, comme source d’oxyde de fer et le laiton, troisième dans la liste des métaux de récupération, comme une source d’oxydes de cuivre. En les associant à un électrolyte aqueux, l’hydroxyde de potassium, KOH, on arrive à un système de batterie sûr et performant.
Pour transformer le métal de récupération en électrodes avec un faible impact sur l’environnement et obtenir qu’on puisse les utiliser sans additifs, le processus d’anodisation est crucial. La figure ci-dessous le schématise et présente des micrographies des surfaces d’électrodes ainsi anodisées
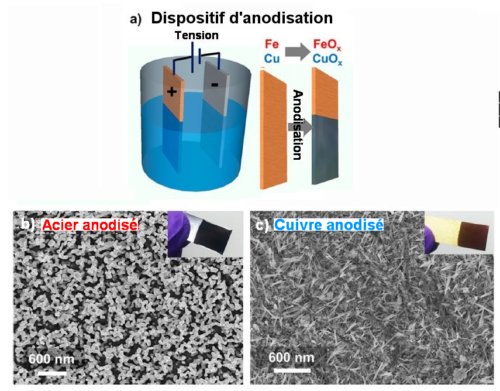
Fig.2. Processus d’anodisation
a) Schéma du processus d’anodisation. L’électrolyte utilisé et le régime de tension appliquée différent selon qu’on anodise l’acier ordinaire ou le laiton.
b) Micrographie au microscope à balayage des nano tiges d’oxyde de fer développées par l’anodisation à la surface de l’acier. L’insert montre une photographie d’une électrode d’acier ainsi traitée.
c) Micrographie au microscope à balayage des nano épines d’oxyde de cuivre développées par l’anodisation à la surface du laiton. L’insert montre une photographie d’une électrode de laiton ainsi traitée.
Adapté de “From the Junkyard to the Power Grid: Ambient Processing of Scrap Metals into Nanostructured Electrodes for Ultrafast Rechargeable Batteries”. Nitin Muralidharan, Andrew S. Westover, Haotian Sun, Nicholas Galioto, Rachel E. Carter, Adam P. Cohn, Landon Oakes, and Cary L. Pint. ACS Energy Lett. 2016, 1, 1034−1041 ©(2016) American Chemical Society
Les électrodes d’acier de récupération anodisé permettent d’obtenir un couple redox Fe3+/Fe2+ correspondant à l’équation d’oxydoréduction :
Fe(OH)2 + OH– ßà FeOOH + H2O + e– .
Les électrodes de laiton anodisé sont plus complexes, leur surface est composée de CuO, Cu2O, CuOH et Cu(OH)2 qui donnent plusieurs couples redox.
Pour démontrer la grande polyvalence de leur procédé, Cary L. Pint et al. ont anodisé des déchets divers de métaux comme des vis, des tubes et des copeaux. Ils les ont ensuite utilisés comme électrodes de batteries. La figure 3 ci-dessous montre que les performances électriques de ces batteries ne varient pas avec la forme d’électrodes de récupération utilisées. Cela pourrait permettre d’améliorer ce type de batteries en utilisant des vis ou des tubes dans des géométries optimisées.
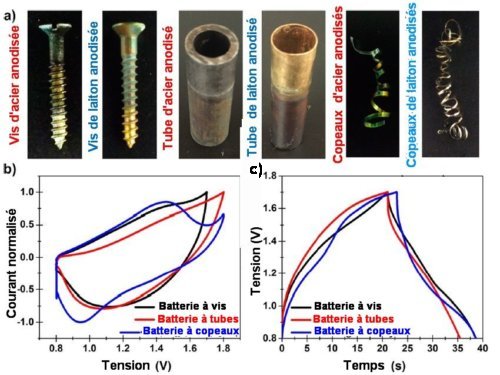
Fig.3 Electrodes de récupération de formes diverses
a) Photographies de vis, tubes et copeaux d’acier et laiton anodisés
b) Cycle de courant en fonction de la tension pour des batteries réalisées avec des électrodes vis, tubes et copeaux de récupération.
c) Courbe de charge-décharge des batteries correspondantes.
Les courbes b) et c) montrent bien que les propriétés électriques des trois types de batterie sont équivalentes.
Adapté de “From the Junkyard to the Power Grid: Ambient Processing of Scrap Metals into Nanostructured Electrodes for Ultrafast Rechargeable Batteries”. Nitin Muralidharan, Andrew S. Westover, Haotian Sun, Nicholas Galioto, Rachel E. Carter, Adam P. Cohn, Landon Oakes, and Cary L. Pint. ACS Energy Lett. 2016, 1, 1034−1041 ©(2016) American Chemical Society
L’intérêt des batteries en métaux de récupération
Pour comparer ces nouvelles batteries à d’autres modèles, il est commode d’utiliser un diagramme dit de Ragone. On porte, en coordonnées logarithmiques, sur un axe la densité massique d’énergie, c’est-à-dire l’énergie disponible par unité de masse, et, sur le deuxième axe, la densité massique de puissance. Plus cette dernière est élevée, plus la décharge de la batterie peut être rapide. On voit bien sur la figure suivante que les batteries à partir de métaux de récupération ont une densité massique énergie du même ordre que les batteries de voiture classiques au plomb (plomb-acide), à peine inférieure à celles des accumulateurs Ni-Fe, Ni-Cd, et Ni-MH. Leur densité massique de puissance est bien plus élevée et cela correspond à des cycles charge-décharge bien plus courts. Cette capacité à stocker l’énergie comme une batterie classique, mais avec un bien plus court temps de charge -décharge rend ces batteries précieuses pour le couplage des réseaux d’électricité à des sources d’énergie électrique renouvelables mais non permanentes.
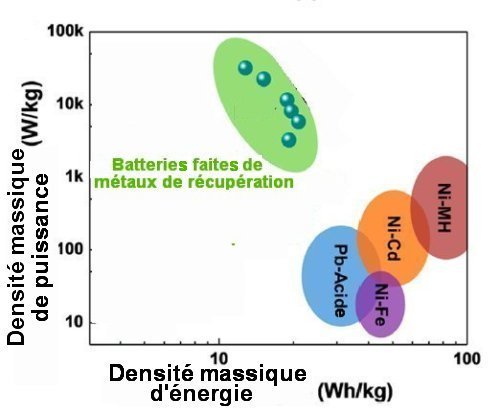
Fig.4. Diagramme de Ragone (coordonnées logarithmiques)
Il permet de comparer les performances des batteries à métaux de récupération à celles de divers modèles de batteries à électrolytes aqueux.
On voit que ces dernières ont une densité massique d’énergie (qui régit la capacité de stockage d’énergie) à peine supérieure à celle des batteries à métaux de récupération. Celles-ci ont en revanche une plus forte densité massique de puissance, donc des propriétés de charge-décharge ultra-rapides.
Reproduit de “From the Junkyard to the Power Grid: Ambient Processing of Scrap Metals into Nanostructured Electrodes for Ultrafast Rechargeable Batteries”.
Nitin Muralidharan, Andrew S. Westover, Haotian Sun, Nicholas Galioto, Rachel E. Carter, Adam P. Cohn, Landon Oakes, and Cary L. Pint. ACS Energy Lett. 2016, 1, 1034−1041 ©(2016) American Chemical Society
On estime qu’il y a énormément de métaux non recyclés dans le monde, 17,5 millions de tonnes d’acier et 1,15 millions de tonnes de cuivre ou laiton.L’anodisation de ces alliages à multi-composants est une opération simple utilisant des produits chimiques peu coûteux et consommant peu de courant. Jusqu’ici, on ne l’avait pas appliquée à des métaux comme l’acier et le laiton dans le but de fabriquer des accumulateurs.
On peut bien sûr envisager une production industrielle de telles batteries. Mais on peut aussi imaginer que ce procédé puisse fournir des électrodes de stockage d’énergie au lieu même de la récupération des métaux dans un environnement local. On pourrait fournir un manuel d’instructions à des utilisateurs d’énergies renouvelables pour leur permettre de fabriquer eux-mêmes leurs solutions locales de stockage d’électricité.
Pour en savoir plus :
From the Junkyard to the Power Grid: Ambient Processing of Scrap Metals into Nanostructured Electrodes for Ultrafast Rechargeable Batteries. Nitin Muralidharan, Andrew S. Westover, Haotian Sun, Nicholas Galioto, Rachel E. Carter, Adam P. Cohn, Landon Oakes, and Cary L. Pint. ACS Energy Lett. 2016, 1, 1034−1041