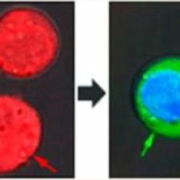
Des nanobulles plasmoniques qui tuent certaines cellules et en traitent d’autres.
Une impulsion laser excite des nanobulles plasmoniques. Celles-ci tuent sélectivement des cellules malades, introduisent un produit dans d’autres cellules tout en laissant vivantes des cellules non concernées. Des chercheurs de Rice University, Houston, Texas, USA, ont mis au point cette méthode rapide, simple et multifonctionnelle qui ouvre un espoir de pouvoir remplacer les procédés compliqués utilisés actuellement pour traiter certains cancers.
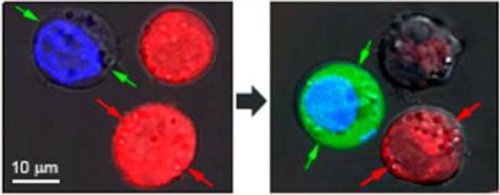
Fig. 1 A gauche, on voit des cellules dites J32
contenant un amas de nanosphères d’or(marqueur
bleu DAPI) ou un amas de coquilles sphériques d’or
(marqueur rouge Calcéine).
A droite, après l’impulsion laser, les cellules teintes en rouge présentent
des dommages dus à l’explosion des nanobulles, tandis que les
cellules teintes en bleu sont intactes mais chargées du colorant
fluorescent vert qui les a pénétrées. Crédit Nano Letters ©ACS 2013.
Les méthodes utilisées jusqu’ici par les thérapies cellulaires et géniques utilisent plusieurs procédures de séparation des cellules d’une culture ex vivo (en dehors du corps) pour, d’une part, éliminer les cellules malades (comme des cellules cancéreuses) et d’autre part traiter un autre ensemble de cellules pour leur conférer une efficacité thérapeutique ou une modification génétique. Elles sont lentes, onéreuses, peu sélectives et conduisent à des pertes de cellules utiles.
Les chercheurs de Rice University présentent une approche nouvelle de ce problème qui tend à obtenir en une même opération dans un système de cellules hétérogène l’élimination d’un groupe de cellules, l’introduction de produits dans un autre groupe tout en gardant une innocuité vis-à-vis du reste des cellules. C’est dans ce but qu’ils ont évalué la potentialité du nouveau groupe d’agents cellulaires multifonctionnels que constituent les nanobulles plasmoniques.
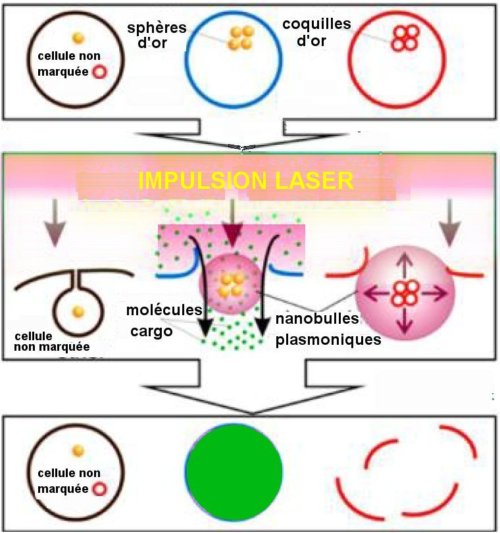
Fig. 2. Schéma du traitement d’un système hétérogène de cellules
par nanobulles plasmoniques. Ces dernières sont générées
sélectivement autour des amas de sphères d’or par une seule
impulsion laser. Ces sphères sont pleines dans les cellules marquées
en bleu et sont de fines coquilles sphériques creuses dans les cellules
en rouge. L’impulsion laser crée par chauffage de petites bulles
plasmoniques dans les cellules bleues qui permettent la pénétration
dans celles-ci de molécules cargo (en vert). Elle crée en même temps
dans les cellules rouges de plus intenses bulles plasmoniques qui
détruisent ces cellules. Les autres cellules restent indemnes.
Crédit Nano Letters ©ACS 2013.
Une bulle nanoplasmonique est une bulle de vapeur transitoire générée autour d’une nanoparticule d’or qui a été chauffée par une courte impulsion laser. Les grosses bulles détruisent les cellules, tandis que les petites, non invasives, créent de minuscules orifices temporaires par où pénètrent des molécules extérieures aux cellules.
Les chercheurs ont utilisé des sphères d’or de 60 nanomètres de diamètre. Les unes étaient des sphères pleines, les autres des coquilles sphériques creuses dont la capacité calorifique est bien inférieure à celle des sphères pleines et qui atteignent donc sous l’action de l’impulsion laser des températures bien plus grandes que les sphères pleines.
La même impulsion laser crée autour des coquilles sphériques des bulles d’un ordre de grandeur 4 fois plus élevé qu’autour des sphères pleines. En réglant judicieusement l’intensité du laser, on peut donc obtenir l’élimination des cellules contenant les coquilles sphériques et la pénétration des molécules cargo désirées dans les cellules contenant les sphères pleines, les autres cellules restant indemnes.
Les expérimentateurs ont utilisé des cellules J32 qui sont des modèles cellulaires de lymphocytes. Ils ont placé des coquilles sphériques d’or dans un premier groupe de cellules teintes en rouge et des sphères solides de même diamètre dans un groupe de cellules de même type teintes en bleu. Les deux groupes ont été placés ensemble dans un colorant vert fluorescent et exposés à une seule courte (70ps) impulsion laser. On a ensuite lavé le colorant vert et examiné les cellules au microscope. Les cellules rouges aux coquilles sphériques ont explosé sous l’effet d’intenses nanobulles plasmoniques, les bleues sont restées intactes, mais le colorant vert les a pénétrées grâce aux petits orifices que les petites nanobulles plasmoniques dues aux sphères d’or pleines ont ouvert temporairement dans leurs parois. (Fig.1)
Cette technique permet d’appliquer plusieurs traitements à la fois à une population cellulaire. On peut imaginer par exemple qu’on puisse injecter une substance dans une cellule souche pour la transformer et qu’en même temps on tue les cellules environnantes qui pourraient être toxiques lors de la réinjection dans un patient.
De nombreuses affections sont actuellement traitées par des thérapies cellulaires ou géniques grâce à la manipulation de cellules pratiquée ex vivo.
La nouvelle technique des nanobulles plasmoniques est prometteuse pour améliorer l’issue de tels traitements. Des expériences sur des cellules humaines sont actuellement envisagées par l’équipe dirigée par Ekaterina Y. Lukianova-Hleb.
Pour en savoir plus :
Cell Systems in a Single Laser Pulse Treatment, Ekaterina Y. Lukianova-Hleb†, Martin B. G. Mutonga†, and Dmitri O. Lapotko†‡, Department of Biochemistry and Cell Biology+, Rice University, and Department of Physics and Astronomy‡, Rice University. ACS Nano, 2012, 6 (12), pp 10973–10981