Des connections biologiques pour la microélectronique
En microélectronique, on a atteint une densité maximum de circuits déposés sur des plaquettes planes. Pour aller plus loin, il serait possible d’empiler les circuits en couches successives, réalisant ainsi une électronique à 3 dimensions. La réalisation d’un réseau dense d’interconnexion entre ces couches pose cependant un redoutable problème.
Des chercheurs du LETI et de l’université Joseph-Fourier à Grenoble ont montré que des filaments d’actine dont ils ont pu contrôler la croissance et utiliser les propriétés d’auto-organisation pouvaient fournir une solution. Le contrôle de la polymérisation des filaments d’actine se fait par voie biochimique. Des réseaux croissant entre deux couches s’interpénètrent pour former des connections stables qu’on peut facilement dorer par métallisation chimique.
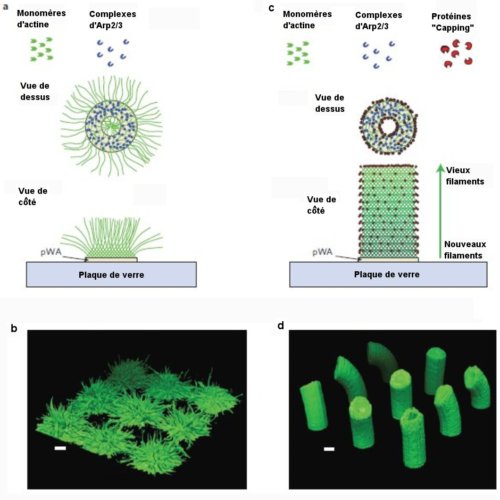
Fig.1. Architecture d’un réseau d’actine poussant sur un motif
microscopique torique en l’absence, a-b, ou en la présence, c-d,
de protéines “capping”.
Les vues b et d sont des reconstructions en 3 dimensions à partir d’
images en microscopie confocale prises sous 3 angles perpendiculaires.
La barre d’échelle vaut 10µm.
Crédit Nature Materials
La sélection des zones de croissance des filaments d’actine
Pour définir les points à partir desquels croîtront les filaments d’actine, on recouvre d’abord une plaquette d’une mince couche de polyéthylène glycol (PEG) sur lequel l’actine ne peut se fixer. Puis, par photolithographie en ultra-violet lointain (Fig.2), on attaque la couche de PEG pour supprimer celui-ci sur de microscopiques motifs toriques ou circulaires à partir desquels croîtront les filaments d’actine.
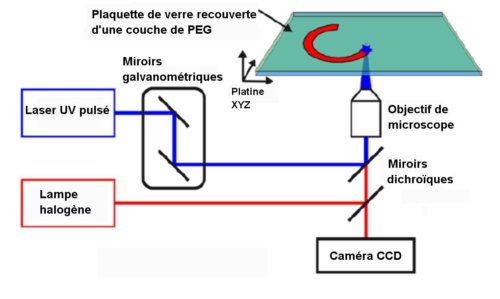
Fig.2.Schéma de l’obtention des motifs de base pour la croissance des connexions d’actine. La couche de PEG repousse les protéines : un laser pulsé UV l’oxyde localement et la rend adhésive.
Crédit Nature Materials.
La polymérisation de filaments tubulaires d’actine
On dépose sur ces motifs un élément de protéine nommé pWA, sur lequel adhère l’actine. Puis on fait couler sur les plaques un mélange de monomères d’actine et du complexe Arp2/3.
On obtient alors des filaments d’actine distribués au hasard autour des sites de nucléation(Fig.1, a, b). En utilisant le mélange précédent auquel on a rajouté des protéines capuchons, on obtient alors des structures en tubes réguliers (Fig.1, c, d)).
Le renforcement mécanique des contacts
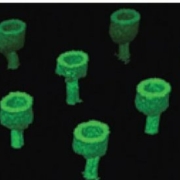
Afin d’obtenir une connexion solide, les chercheurs ont imprimé sur les faces en regard de plaquettes des motifs respectivement circulaires et toriques. Ils ont ainsi obtenu un contact du genre prise mâle-femelle (Fig. 3 ci-dessous).
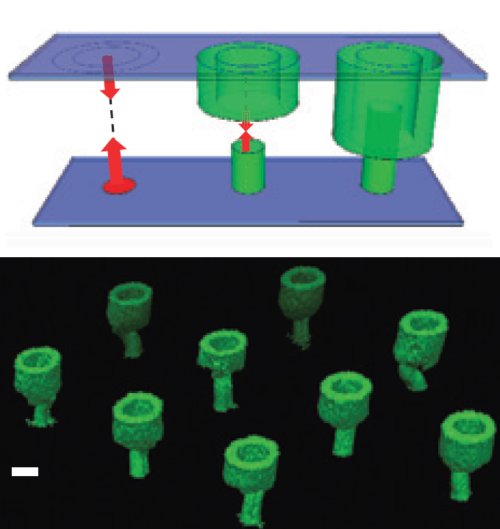
Fig. 3. En haut : Schéma des connections formées par des cylindres entrant dans des tubes creux. Les flèches représentent la croissance du réseau. En bas : Vue en 3D d’un réseau régulier de structures d’actine connectant deux surfaces parallèles distantes de 60µm. La barre d’échelle vaut 10µm. Crédit Nature Materials.
Une conductivité obtenue par dépôt d’or
Pour obtenir une conductivité suffisamment élevée, les tubes d’actine sont dorés. Pour cela des nano-particules de sels organiques d’or sont d’abord incorporés au mélange conduisant à la polymérisation de l’actine, puis une solution commerciale de dorure s’accrochant sur les nano-particules d’or parfait le revêtement.
Ces spécialistes de biologie cellulaire associés à des physiciens ont réussi un véritable exploit. Les filaments d’actine rendue conductrice ne connectent pour l’instant que des plaques de verre, mais leurs dimensions(10 µm de diamètre sur quelques 70 µm de long) sont bien adaptées au besoin de la microélectronique. En outre, l’utilisation de diverses protéines doit permettre de modifier la forme et les propriétés des filaments d’actine. Tout ceci laisse envisager nombre d’applications dans les domaines microscopiques et nanoscopiques.
Pour en savoir plus :
Fabrication of three-dimensional electrical connections by means of directed actin self-organization
Rémi Galland1, Patrick Leduc2, Christophe Guérin1, David Peyrade3, Laurent Blanchoin1
and Manuel Théry1 , Nature Materials, 30 february 2013, DOI: 10.1038/NMAT3569
1Institut de Recherches en Technologies et Sciences pour le Vivant, iRTSV, Laboratoire de Physiologie Cellulaire et Végétale, CNRS/CEA/INRA/UJF, Grenoble 38054, France,
2Laboratoire d’Electronique des Technologies de l’Information, LETI, Laboratoire d’Empilement de Circuits Avancés, CEA, Grenoble 38054, France,
3Laboratoire des Technologies de la Microélectronique, CNRS/UJF-Grenoble1/CEA LTM, Grenoble 38054, France.