Un dispositif extra-corporel de purification du sang pour traiter le sepsis
Le sepsis, appelé autrefois septicémie, qui signifie infection du sang, est une infection générale et grave de l’organisme par des germes pathogènes. Il résiste souvent aux thérapies antibiotiques les plus extrêmes. Des chercheurs de Harvard University, à Cambridge et Boston MA, USA, ont conçu et réalisé un dispositif extra-corporel, dont l’architecture microfluidique est directement inspirée de celle de la rate, et qui est capable d’extraire des bactéries pathogènes du sang grâce à des nanoparticules magnétiques enduites d’opsonines humaines modifiées.

Fig.1. Vue du dispositif de purification du sang appliqué (à gauche de la photo) à un rat de laboratoire anesthésié. On aperçoit en haut à droite (en rouge) un pousse-seringue qui injecte les opsonines magnétiques dans le mélangeur avant la boucle d’incubation et l’unité de séparation
Crédit Nature Medicine.
Une forte densité d’éléments pathogènes dans le sang aggrave la maladie et augmente la mortalité de patients atteints de sepsis. C’est pour cela que les chercheurs de Harvard University ont mis au point une technique extra-corporelle qui peut rapidement retirer micro-organismes et endotoxines du sang sans même avoir besoin de les identifier et sans modifier la composition sanguine.
L’obtention de molécules pouvant se lier aux toxines
Il fallait d’abord trouver des particules susceptibles de se lier aux bactéries et endotoxines. A partir de molécules particulières appelées opsonines existant dans les êtres vivants, les chercheurs ont, en utilisant les méthodes de la biotechnologie, fabriqué par ingénierie génétique de nouvelles opsonines qu’ils ont collées sur des petites sphères magnétiques de 125 nm de diamètre. Un champ magnétique permet de les déplacer.
Pour obtenir une opsonine à large spectre utilisable sans complications pour purifier le sang, les chercheurs de Harvard University ont choisi de modifier une protéine existant dans les êtres vivants, la lécithine liant le mannose, en anglais mannose binding lecithine,abrégée en MBL (Fig.2 a) qui se lie à de nombreux pathogènes mais induit une coagulation du sang. On a supprimé les régions en hélices de collagène de la grosse protéine (650 kDa) MBL qui sont responsables de la coagulation. Les domaines restants assurent la reconnaissance des carbo-hydrates se trouvant à la surface des germes pathogènes. On les allie à la protéine humaine IgG1Fc pour donner une protéine, FcMBL plus petite (90 kDa) d’une grande efficacité pour la purification du sang et qui n’entraîne pas de coagulation.
Ces protéines peuvent se coller avec une forte densité sur des nanosphères magnétiques enduites de streptavidine en dirigeant vers l’extérieur leur domaine de reconnaissance des carbo-hydrates (DRC) (Fig.2 c).
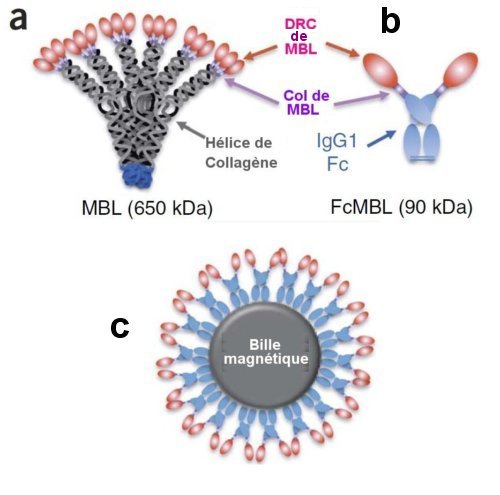
Fig.2.
a) MBL est une protéine native dans l’espèce humaine On la trouve en particulier tapissant les voies respiratoires.Les extrémités en rose sont les « domaines de reconnaissance de carbo-hydrates » (DRC)
b) La petite protéine FcMBL obtenue par fusion des DRC avec la protéine humaine IgG1Fc.
c) Nanosphère (125 nm de diamètre) recouverte de protéines Fc MBL dont les DRC pointent vers l’extérieur. Crédit Nature Medicine.
La streptavidine est une protéine de 53 kDa extraite de la bactérie Streptomyces avidnii. Elle est très utilisée en biologie moléculaire en raison de ses fortes interactions avec de nombreux composés.
Des études in vitro ont montré que les opsonines magnétiques ainsi réalisées gardaient les mêmes propriétés de liaison avec les éléments pathogènes et les endotoxines que la molécule MBL. Cela s’est avéré pour Candida albans, Saccharomyces cervisiae, Esterichia coli, Staphyllococcus aureus et même pour de multiples organismes résistants aux antibiotiques comme S. aureus résistant à la méthicilline , S. epidermidis et Klebstella pneumoniae.
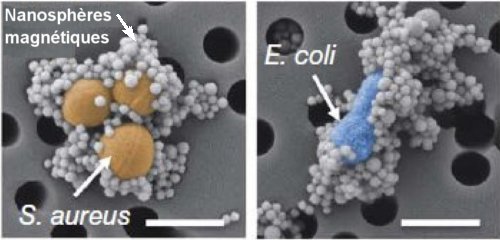
Fig. 3. Micrographies obtenues au microscope électronique à balayage.
Elles montrent les nanosphères magnétiques recouvertes d’opsonines
liées aux bactéries Staphylococcus aureus (teinté en orange à gauche)
et Esterichia coli (en bleu, à droite). Les barres d’échelle valent 1 µm.
Crédit Nature Medicine.
Après avoir ainsi résolu le problème de la fixation des bactéries et endotoxines du sang sur les nanosphères magnétiques, il fallait ensuite concevoir un dispositif capable de séparer celles-ci du liquide sanguin.
La réalisation du dispositif de filtration sanguine
Le dispositif de filtration sanguine réalisé (Fig.1.) imite la structure et le fonctionnement de la rate. Sur la figure 4, à gauche, on peut voir une schématisation d’un canal de pulpe rouge artérielle de la rate avec des sinus (fins canaux entre cellules endothéliales) qui permettent le passage de la circulation artérielle de la rate à sa circulation veineuse. Cela permet, entre autres, l’élimination par des macrophages résidant dans le système veineux d’éléments pathogènes venant de la pulpe rouge de la rate.
A droite de cette figure, on trouve le schéma du dispositif de séparation magnétique.
Le sang infecté chargé des opsonines magnétiques injectées dans la boucle d’incubation de la figure 1 passe dans le compartiment micro-fluidique« artériel » inférieur. Des fentes horizontales font communiquer cette cavité avec le compartiment micro-fluidique « veineux » supérieur où circule une solution saline. Sous l’action d’aimants permanents, les opsonines s’étant liées aux bactéries et endotoxines vont, en passant par les fentes, se retrouver dans le flux « veineux » de solution saline et être éliminées.
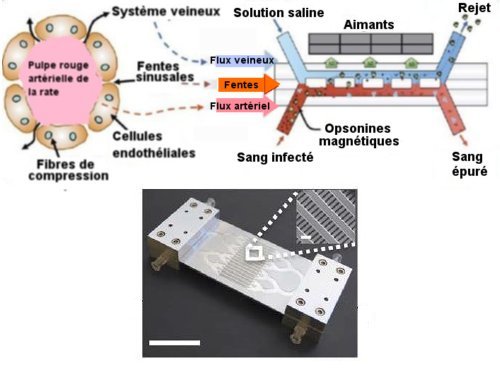
Fig.4. En haut, à gauche, schéma d’un élément de rate. La pulpe rouge est entourée de cellules endothéliales séparées par des fentes sinusales par où la circulation artérielle de la pulpe peut communiquer avec la circulation veineuse.
En haut, à droite, schéma du dispositif de séparation magnétique des opsonines du sang.
En bas, photographie de la plaque munie de fentes permettant la communication entre le flux sanguin et la solution saline, la barre d’échelle vaut 50 mm. Dans l’insert, où la barre d’échelle vaut 20mm, on voit un agrandissement des fentes. Chacune mesure 2mm de long et 0,34 mm de large. la distance entre deux fentes est de 0,43 mm, l’épaisseur de la plaque de fentes est de 0,34 mm. Les couches de fluides sanguins et salins ont une épaisseur du même ordre. Crédit Nature Medicine.
.
Pour tester le système de purification du sang in vivo, on l’a branché (Fig. 1) sur les veines jugulaires de rats anesthésiés. On a d’abord vérifié la biocompatibilité du système en y faisant circuler le sang d’un animal durant 5 H sans noter d’effets notables ni sur sa physiologie (respiration et température), ni sur la coagulation du sang. Enfin, avec des rats dont le sang avait été infecté, on a pu observer que le dispositif enlevait 90% de Staphylococcus aureus et d’Esterichia coli vivants en moins d’une heure et qu’en 5 H de traitement on obtenait des taux d’éléments pathogènes inférieurs à 0,01 pour S. aureus et 0,004 pour E. coli.
La vidéo suivante présente des vues de détail des circuits microfluidiques et des fentes, puis une vue du mouvement des opsonines magnétiques du flux sanguin au flux salin. Pour cela, on a utilisé un système de filtration en PDMS transparent et on a incorporé dans 1 ml de sang humain des particules fluorescentes en vert à la place des éléments pathogènes.
[jwplayer mediaid= »18702″]
Cette méthode de purification du sang par dialyse permet de faire passer plusieurs fois le volume total du sang d’un patient à travers le dispositif en un seul traitement. Ainsi, même si une partie seulement des germes pathogènes est enlevée en une seule passe, la charge totale dans le sang peut être diminuée de façon significative plusieurs fois par jour. Cette thérapie ne pourra, certes, supprimer les éléments pathogènes dans les organes ou les abcès, mais elle peut réduire la propagation dans l’organisme des agents infectieux et diminuer le niveau d’endotoxines, de bactéries et d’hémoglobine libre toxique. Ce traitement peut, en particulier, permettre d’attendre le temps nécessaire à l’identification du facteur infectieux pour administrer l’antibiotique optimum. Enfin cette technique pourrait être utilisée pour débarrasser le sang de protéines (comme les autoanticorps) ou de cellules de types divers, (comme des cellules cancéreuse en circulation, des cellules souches, des cellules fétales dans le sang maternel) en enduisant les particules magnétiques de molécules se liant spécifiquement à ces cellules ou ces molécules.
Pour en savoir plus :
An extracorporeal blood-cleansing device for sepsis therapy,
Joo H Kang, Michael Super, Chong Wing Yung, Ryan M Cooper, Karel Domansky, Amanda R Graveline, Tadanori Mammoto, Julia B Berthet, Heather Tobin, Mark J Cartwright, Alexander L Watters, Martin Rottman, Anna Waterhouse, Akiko Mammoto, Nazita Gamini, Melissa J Rodas, Anxhela Kole, Amanda Jiang, Thomas M Valentin, Alexander Diaz, Kazue Takahashi & Donald E Ingber
Nature Medicine, oct. 2014



