Des nanoplaquettes d’oxyde de cuivre pour remplacer le platine des pots catalytiques
Les pots catalytiques qui équipent les automobiles sont destinés à neutraliser les gaz produits par la combustion de l’essence. Il s’agit essentiellement du monoxyde de carbone CO et des oxydes d’azote NOx. C’est à partir de métaux très onéreux issus des minerais du platine (platine Pt, palladium Pd et rhénium Rh) que sont préparés les catalyseurs utilisés. Ils ne fonctionnent bien qu’à haute température. Ils sont donc mal adaptés à la dépollution des gaz d’échappements des motos et scooters de faible cylindrée qui rejettent des gaz de température peu élevée (<300°C). Une équipe internationale de chercheurs indiens, japonais et chinois a pu montrer qu’un oxyde de cuivre très abondant, le CuO pouvait présenter, sous une forme idoine, même à faible température, une activité catalytique supérieure à celle des catalyseurs onéreux issus de la mine du platine.
Détermination de la surface la plus réactive
Depuis quelques dizaines d’années , on cherche à remplacer les catalyseurs habituels des pots d’échappement par des oxydes de divers métaux courants capables d’assurer la dépollution des oxydes d’azote NOx.
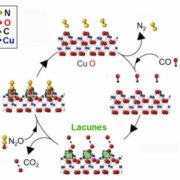
Les chercheurs ont démontré théoriquement, dans le cas d’un des oxydes du cuivre, CuO, que c’est la face cristallographique {001} qui présentait la réactivité chimique la plus élevée. Ils ont donc mis au point une préparation de CuO dans laquelle on obtient des nanoplaquettes interfoliées ayant cette orientation préférentielle. La géométrie des plans {001} présente des atomes d’oxygène protubérants (Fig.1). Les molécules de monoxyde de carbone CO adsorbées à la surface réagissent avec ces atomes d’oxygène pour donner du bioxyde d’azote CO2. Cela crée des lacunes qui vont piéger les atomes d’oxygène des diverses espèces d’oxydes d’azote, NOx, permettant ainsi un dégagement de molécules d’azote N2. Sur la figure 1, on a schématisé cette réaction pour l’espèce chimique particulière NO (le très toxique monoxyde de carbone), mais le principe reste le même pour tous les NOx.
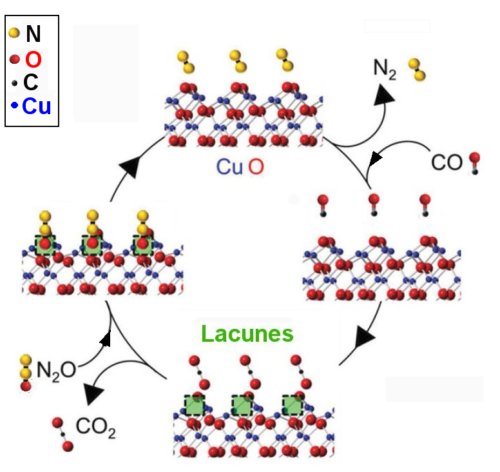
Fig.1. Vue en perspective de la géométrie d’une surface idéale{001} de CuO (elle est perpendiculaire à la verticale de la figure). Le schéma illustre un cycle d’élimination catalytique de NOx avec adsorption de CO. Les atomes d’oxygène de la surface {001} du CuO se combinent aux atomes de CO incidents pour former du CO2 en créant ainsi des lacunes d’oxygène. Ces lacunes vont capter les atomes d’oxygène de NOx tandis que les facettes de CuO retrouvent leur état initial et que de l’azote N2 se dégage. On a utilisé ici NO comme représentant des NOx pour simplifier le schéma de réaction. Les atomes d’azote sont représentés par des boules jaunes, ceux d’oxygène par des boules rouges, ceux de carbone par des noires ceux de cuivre par des bleues.
Crédit ADVANCED MATERIALS Creative Commons.
La synthèse de fins monocristaux de CuO avec des facettes {001}
Lee processus utilisé est simple : c’est une réaction hydrothermique en présence d’un ligand.
Un mélange de CuCl2, d’urée et d’éthylène glycol, qui constitue le ligand, est mélangé à de l’eau et chauffé à 140°C durant 15 heures. La figure ci-dessous illustre le résultat de ce traitement.

Fig.2. Images du CuO préparé dans les conditions optimales indiquées sur la figure.
a) Photographie de la poudre noire obtenue.
b) Au microscope électronique à balayage, elle se révèle composée de minces cristaux de CuO assemblés en sortes de fleurs.
c) A grossissement 10 fois plus élevé, on distingue les nanoplaquettes. Crédit Advanced Materials.
Une étude au microscope électronique à transmission à haute résolution révèle que les arrangements atomiques en surface du CuO ainsi obtenu sont bien caractéristiques de surfaces {001} (on le dénomme CuO-1). En faisant passer sur sa surface du monoxyde d’azote et du monoxyde de carbone à la température de 175°C , on a pu observer une conversion du dangereux NO en N2 ou en NO2 moins toxique parce que plus stable. En outre le CuO-1 ainsi préparé surpassait en capacité catalytique toutes les autres formes d’oxydes de cuivre et les nanoparticules de platine. Un usage répété n’entraînait pas de détérioration de ses propriétés catalytiques.
Une expérience en conditions réelles montre que le CuO-1 peut enlever le NO contenu dans le gaz d’échappement de petits véhicules (figure 3 ci-dessous).
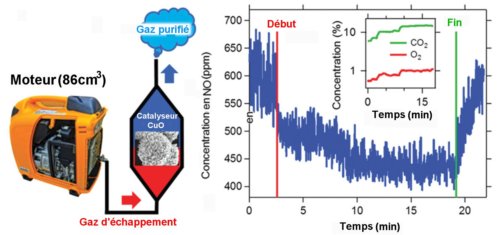
Fig.3 Dépollution catalytique de NO dans un gaz d’échappement réel. A droite on a tracé en fonction du temps la concentration massique de NO dans le gaz d’échappement exposé ou non au CuO-1 à une température de 170°C. Dans l’insert, on a représenté les pressions partielles (c’est-à-dire la concentration en pourcentage) de CO2 et O2 présents dans le gaz d’échappement. Crédit Advanced Materials.
Le gaz s’échappant d’un moteur à essence du commerce de faible cylindrée (86 cm3) avec un débit de 100cm3/min et à une température de 170°C est envoyé sur du CuO-1. La concentration initiale de NO dans le gaz d’échappement est d’environ 600 ppm (ppm = partie par million), mais elle décroît vite à la limite de détection du senseur de gaz utilisé (400 ppm) lors de l’ exposition au catalyseur (indiquée par Début sur le graphe de la Fig.3) . Lors de l’arrêt de l’exposition (indiquée par Fin), elle remonte à sa valeur initiale. Le gaz d’échappement contient 10% en volume de CO2, 4% de H2O et 1% de O2.
Un oxyde de métal comme le cuivre peut donc fournir un catalyseur capable de dépolluer même l’échappement de véhicules de petite cylindrée. On peut étendre cela à d’autres métaux, à condition d’identifier théoriquement leur surface la plus réactive et de pouvoir synthétiser ces oxydes avec un maximum de surface réactive utile.
Cette approche ouvre la voie à l’obtention de catalyseurs pour pots d’échappement à partir de ressources abondantes et peu onéreuses.
Pour en savoir plus :
Low-Temperature Remediation of NO Catalyzed by Interleaved CuO Nanoplates
Francis Malar Auxilia, Shinsuke Ishihara, Saikat Mandal, Toyokazu Tanabe, Govindachetty Saravanan, Gubbala V. Ramesh, Naoto Umezawa, Toru Hara, Ya Xu, Shunichi Hishita, Yusuke Yamauch, Arivuoli Dakshanamoorthy, Jonathan P. Hill, Katsuhiko Ariga, and Hideki Abe
Adv. Mater. 2014, DOI: 10.1002/adma.201306055